Биоремедиация морских прибрежных экосистем: использование искусственных рифов
Одной из основных задач при проведении экологического мониторинга морских прибрежных экосистем, наряду с оценкой и прогнозом их состояния, является биоремедиация нарушенных биоценозов. Это относится в первую очередь к биотическим сообществам, подверженным воздействию антропогенного фактора. В экологической реконструкции с целью оптимизации процесса развития и их устойчивости особенно нуждаются бентосные сообщества как наиболее уязвимые при загрязнении прибрежных вод [1].
Известно, что устойчивость экосистемы к воздействию антропогенного фактора обеспечивается на разных уровнях ее организации в соответствующих временных масштабах. Наиболее надежный способ восстановления экосистемы состоит в изменении условий среды, вызвавших нарушения, что в большинстве случаев осуществить практически нереально. Поэтому чаще предпринимаются попытки воздействовать на биотическое сообщество путем восстановления его структуры и видового разнообразия, поскольку сложно организованные биоценозы требуют меньше энергии на поддержание их структуры. Причем с ростом видового разнообразия в сообществе резко возрастает объем биологической информации и, соответственно, устойчивость экологической системы в целом [2; 3].
В прибрежных морских экосистемах основными первичными продуцентами органического вещества являются бурые, красные и зеленые многоклеточные водоросли, обеспечивающие бентосное сообщество органическим веществом, поскольку доля фитопланктона в производстве продукции в прибрежной зоне моря ниже [4]. Водоросли донных фитоценозов в процессе трансформации солнечной энергии изымают из среды и аккумулируют многие химические элементы, включая многие ксенобиотики, и участвуют в биологической очистке воды [5].
Развитие донных фитоценозов в прибрежной зоне моря зависит прежде всего от наличия твердого субстрата, необходимого для прикрепления водорослей, и движения водной массы, которая удаляет продукты обмена и доставляет вещества, необходимые для функционирования биотического сообщества. Для увеличения площади субстрата для роста водорослей в литоральной зоне моря сооружаются искусственные рифы (ИР). Они создаются с целью восстановления деградированных донных сообществ, увеличения биологической продуктивности и интенсификации процессов очистки воды в местах сброса сточных вод предприятий рыбного хозяйства, в акваториях, используемых для аквакультуры, и рекреационных зонах морей. Бентосные микро-и макроводоросли водоросли одними из первых заселяют ИР, подготавливая среду для последующего
формирования сложных биоценозов, которые выполняют в прибрежных водах морей функцию мощных биологических фильтров [6].
В водных экосистемах масштаб и скорость биологической фильтрации биотическим сообществом обеспечивают многократное использование биогенных элементов и органического вещества. Фильтрация воды представляет собой основу питания взвешенными частицами, различными по строению и систематическому положению водных организмов. Биологическая фильтрация в прибрежных водах не только является одним из основных способов получения пищи многими гидробионтами, но и представляет собой глобальную многоступенчатую систему процесса самоочищения среды. Бентосные организмы, включая грубых и тонких фильтраторов, принимают активное участие в биологической очистке природных вод [7; 8].
Долгое время ИР сооружались в прибрежной зоне моря с целью увеличения рыбной продукции и для любительского лова в околорифовом пространстве. Существенно меньше уделялось внимания применению ИР для экологической мелиорации и биологической очистки акваторий от загрязняющих веществ. До последнего времени большая часть работ на ИР носила объектный характер и практически не затрагивала изучения гидробионтов, формирующих риф и обеспечивающих его функционирование как единого сообщества. Это, в первую очередь, касается исследования особенностей развития рифового сообщества в прибрежной экосистеме, функционирование которой обеспечивается взаимодействием абиотических и биотических факторов, особенно -наличием в сообществе разных экологических групп гидробионтов, включая продуцентов, консументов и деструкторов неутилизированного органического вещества.
Природное очищение морской среды, часто называемое самоочищением воды, представляет собой совокупность взаимосвязанных гидрологических, гидрохимических и гидробиологических процессов, направленных на поддержание или восстановление экологического благополучия водной экосистемы. В последние годы заметно возросло влияние антропогенного фактора на прибрежные морские экосистемы, особенно на промышленные и рекреационные зоны, что негативно сказывается на способности природной среды к самоочищению. В этой связи возникает необходимость разработки новых подходов к осуществлению экологического мониторинга с целью восстановления и реконструкции водных биоценозов, обеспечивающих биологическую очистку нарушенной морской среды.
Авторами проведены исследования стадий колонизации ИР и формирования рифового биоценоза с целью выявления экологической роли гидробионтов, обеспечивающих процесс биологической очистки прибрежных морских экосистем. В данной статье приводятся результаты исследований.
Район работ, материал и методы исследования
Исследования развития биоценозов на искусственном рифе проводили в сублиторальной зоне на специальных полигонах в северо-восточном районе Черного моря. При сооружении рифов был выбран камень ракушечник размером 150 х 400 мм, покрытый сеткой. Рифы площадью от 5 до 20 м2 сооружались на глубине до 10 м на илисто-песчаном грунте с учетом течений, волновых явлений и произрастания водорослей в зоне сооружения рифа. При этом видовой состав гидробионтов в околорифовом пространстве исследовали на глубинах от уреза воды до границы роста красных водорослей. Для визуального наблюдения применяли легкое водолазное снаряжение [9]. При изучении количественного распределения гидробионтов на рифе использовали рамки площадью 0,1 м2 и 0,25 м2.
Пробы анализировали по следующим показателям: видовому и размерному составу, численности (экз./м2) и биомассе (г/м2, г/кг таллома). Для определения удельной поверхности талломов (S/W) отбирали 10 экземпляров растений, которые расчленяли на структурные элементы, вырезая участки из базальной, средней и апикальной части водоросли. Удельную поверхность водорослей определяли как площадь таллома на единицу массы (S/W) и рассчитывали по известным формулам [10]. Высечки талломов после обсушки взвешивали на электронных весах с точностью до 0,001 г.
Эпибионтный комплекс гидробионтов для определения его видовой принадлежности удаляли пинцетом, делали соскоб или смывали с талломов и помещали в фильтрованную морскую воду. При определении видового состава использовали как живые, так и фиксированные препараты, которые готовили следующим образом. Одноклеточные водоросли отмывали от раствора, переносили на покровное стекло, добавляли несколько капель перекиси водорода и выжигали на пламени через асбестовую прокладку. Затем на предметное стекло с канадским бальзамом помещали покровное стекло с водорослями [11]. Фиксированные пробы воды и соскобы с камней рифа помещали в стерильные пробирки с раствором эритрозина для окрашивания бактерий и спустя 5 мин фильтровали (Millipore) и микроскопировали.
Пробы беспозвоночных отбирали, обрабатывали, фиксировали и готовили к определению следующим образом. Слоевища водорослей с эпибионтами помещали в сосуды с фильтрованной морской водой, продували в течение 15 мин азотом для удаления из среды кислорода. После того, как эпибионты отделялись от слоевищ и перемещались к поверхности, пробы промывали и процеживали через систему сит из мельничного газа. Освобожденные от эпифитов слоевища просматривали под бинокуляром и по необходимости с них делали соскобы. Пробы фиксировали раствором 75 % этанола, разбирали по группам гидробионтов, обсушивали
их фильтровальной бумагой, обмеряли и взвешивали. Организмы мейобентоса помещали в сосуды с фиксирующим раствором, определяли видовую принадлежность и просчитывали в камере Богорова.
Результаты исследования и обсуждение
Эксперименты по созданию ИР с использованием различных материалов выявили некоторые общие закономерности, которые необходимо учитывать при сооружении рифового комплекса в прибрежных водах. Хорошие результаты были получены на рифах неправильной формы с шероховатой поверхностью для лучшего прикрепления гидробионтов и создания им благоприятных условий обитания. При сооружении рифа нужно использовать пористый камень, покрытый сеткой, с многочисленными внутренними полостями для увеличения площади поверхности субстрата. Рифовые конструкции следует размещать перпендикулярно берегу в шахматном порядке. Для эффективной колонизации рифа необходимо учитывать также сроки размножения водорослей и оседания личинок беспозвоночных на субстрат. При сооружении ИР также чрезвычайно важно учитывать прибрежные течения, которые способствуют расселению личинок донных гидробионтов.
Для сооружения ИР был выбран участок дна с оптимальным соотношением физических и биологических параметров, обеспечивающих наиболее эффективное использование водного пространства в процессе развития рифового сообщества и биологической фильтрации воды. Оптимальной глубиной для развития многоярусного фитоценоза как начального этапа развития зрелого сообщества ИР оказались глубины 5-7 м с илисто-песчаными грунтами. При выборе конструкции учитывались физические параметры, включая массу (W), объем (V) и поверхность (S) рифа, от которых в значительной мере зависит биомасса обрастаний [1]. В качестве контрольных полигонов были выбраны участки дна, на которых непосредственное влияние рифа на распределение гидробионтов не проявляется.
Колонизация твердого субстрата гидробионтами представляет собой пример экологической сукцессии, причем каждый предшествующий этап обеспечивает развитие последующих стадий заселения рифа. Начальная стадия продолжительностью несколько суток характеризуется появлением на твердом субстрате бактерий, одноклеточных подвижных бентосных диатомовых водорослей рода Navícula (N. pennata, N. directa) и Nitzschia sp. Затем в обрастаниях обнаруживаются неподвижные диатомовые водоросли Cocconeis scutellum, а также колониальные формы диатомей Achnanthtes brevipes, Synedra tabuta, Licmophora sp. [12].
Формирование бактериальной пленки начинается практически сразу после погружения камней ракушечника в море. Палочковидные бактерии оседают на субстрат и прочно закрепляются уже спустя 2-3 ч. Одновременно с ними начинаю оседать и диатомовые: хотя их численность на этапе формирования слизистой пленки на субстрате существенно меньше, чем бактерий. Спустя несколько суток численность диатомовых водорослей резко возрастала как за счет оседания новых клеток, так и в результате делении ранее осевших, особенно при сооружении рифа в периоды весеннего или осеннего пика численности диатомовых. Известно, что водоросли выделяют в среду продукты обмена, которые служат бактериям источником питательных веществ. Кроме того, живые клетки водорослей и створки отмерших служат субстратом для закрепления бактерий. Бактерии в свою очередь выделяют углекислый газ, нитраты, фосфаты и другие вещества, необходимые для роста водорослей.
Продолжительность следующего этапа может составлять несколько недель или даже месяцев в зависимости от температуры воды и времени постановки рифа. Так, в Белом море пелагический образ жизни зооспор ламинарии длится от нескольких минут до нескольких суток в зависимости от температуры воды. С понижением температуры воды (< 10 °C) превращение подвижных зооспор в эмбриоспоры при оседании на твердый субстрат и образование проростков замедляется [13].
Развитие рифового сообщества представляет собой серию последовательных изменений в его биологической организации и рост видового разнообразия, в котором взаимодействия между гидробионтами становятся сбалансированными, а структура - близкой к комплиментарной. С ростом видового разнообразия в сообществе увеличивается объем биологической информации, что способствует устойчивости экосистемы. В ходе сукцессии увеличивается биомасса и продукция сообщества и устанавливаются устойчивые межвидовые связи между гидробионтами разных трофических уровней. На этом фоне происходит согласование ритмов и циклов развития видов сообщества с различными экологическими стратегиями [3].
Через 4 месяца на рифе на глубине 7 м появились проростки бурой водоросли цистозиры, а через 12 месяцев экспозиции начал формироваться многоярусный фитоценоз с видом-эдификатором Cystoseira barbata (рис. 1). Среди сопутствующих водорослей рифового биоценоза обнаружено 8 видов красных, 6 бурых и 4 зеленых. Хотя данный биоценоз отличался от зрелого по видовому разнообразию и биомассе водорослей, в реальности он представлял собой сложное сообщество с большой активной поверхностью за счет микро- и макроэпифитов, поселившихся на субстрате и слоевищах водорослей. На других рифах видами-эдификаторами фитоценоза в зависимости от глубины были Cystoseira barbata, C. crinita или Phyllophora nervosa с числом общих видов в сообществах до 80 %. Так, на глубине 2,5 м развился фитоценоз C. barbata биомассой 6,5 кг/м2, в составе которого обнаружено 16 видов водорослей: 8 красных, 4 бурых и 4 зеленых. При аналогичных условиях на соседнем рифе на глубине 6,5 м сформировалось сообщество, в котором доминировала C. crinita с биомассой 1,9 кг/м2, а в числе сопутствующих видов оказалось 11 красных,
8 бурых и 6 зеленых водорослей. Слоевища водорослей покрывали многочисленные гидроиды (Sertulatella polyzonias, Aglaophenia pluma), полихеты (Pomatoceros triqueter, P. militaris), губки (Halichondria panacea, Halicona implexa), мшанки (Lepralia pallasiana, Memdranipora pülosa) и колониальные асцидии (Botryllus schlosseri). При этом с увеличением глубины, на которой сооружался риф, биомасса бурой водоросли цистозиры на рифе заметно падала, а красных водорослей и эпифитов - возрастала (табл. 1).
Биомасса и площадь поверхности талломов водорослей фитоценоза Cystoseira crinita
Глубина, м Cystoseira crinita Водоросли нижних ярусов Водоросли - эпифиты слоевищ
Биомасса, г/м2 S талломов, м2 Биомасса, г/м2 S талломов, м2 Биомасса, г/м2 S талломов, м2

Другим важным условием функционирования рифа является постоянный обмен воды в околорифовом пространстве. В водных экосистемах взаимодействия между гидробионтами сообщества осуществляются посредством контакта с водой, представляющей собой сложную систему растворенных и взвешенных веществ [14]. Специфической формой таких взаимодействий служат выделяемые гидробионтами метаболиты, которые выполняют в экосистеме информационную и физиолого-экологическую функции. Метаболиты гидробионтов регулируют рост, размножение и образование покоящихся стадий развития собственной популяции, элиминируют конкурентов за ресурсы и ингибируют развитие партнеров по сообществу. Они служат важным интегрирующим фактором, поддерживающим сбалансированную плотность популяций гидробионтов в сообществе.
Ослаблению конкуренции в сообществе способствуют многочисленные эпифиты, повышающие резистентную устойчивость. На слоевищах водорослей основного яруса фитоценоза цистозиры обитают облигатные эпифиты - красные водоросли Polysiphonia subulifera, Ceramium rubrum, бурые - Cladostephus verticillatus, которые поселяются обычно на поврежденных участках таллома и на месте сброшенных рецептакул, используя метаболиты в качестве питательных веществ. Некоторые из красных эпифитов выделяют вещества, подавляющие рост ювенильных стадий эпифитных бурых и зеленых водорослей [15]. В биоценозе рифа положительные взаимодействия между популяциями оказываются более важными, чем жесткая конкуренция, особенно на стадии сформировавшейся структурно-функциональной организации биотического сообщества, направляя потоки вещества и энергии на сохранение целостности экосистемы [16; 2].
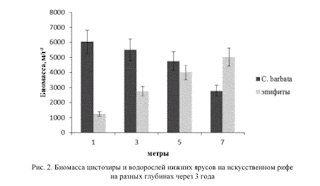
В исследуемом районе Черного моря фитоценозы цистозиры имеют четко выраженную ярусность с преобладанием в растительном сообществе красных водорослей. Обычно нижний ярус занимают корковые формы багрянок Melobesia farinosa, Lithotamnion lenormandi, Phymatolithon polymorphum. Следующий ярус образуют красная водоросль Laurencia obtusa, бурая Cladostephus verticullatus и зеленая Enteromorpha linza. При этом на талломах цистозиры, которая занимает основной ярус, поселяются многочисленные красные водоросли-эпифиты: Polysiphonia subulifera, Acrochaetium thuretii, Ceramium rubrum и др. Причем биомасса эпифитов через три года экспозиции на глубине 3 м достигает 30-40 % биомассы сообщества, а на глубине 7 м превосходит биомассу цистозиры (рис. 2). При этом активная поверхность эпифитов превышает таковую цистозиры в несколько раз [5]. Во всех исследованных нами рифовых сообществах красные водоросли доминировали по видовому разнообразию, активной поверхности талломов, а в фитоценозах с видом-эдификатором филлофорой и по биомассе.
Рис. 2. Биомасса цистозиры и водорослей нижних ярусов на искусственном рифе на разных глубинах через 3 года
Величина удельной поверхности слоевища (S/W) бентосных водорослей представляет собой чрезвычайно важный показатель, определяющий уровень и скорость метаболических процессов водных организмов. В биоценозах ИР красные водоросли с расчлененными талломами являются функциональными доминантами сообщества за счет большой поверхности слоевищ. Обычно многолетние виды-эдификаторы сообщества обладают относительно невысоким отношением S/W слоевищ: Cystoseira crinita - 9 м2/кг, а Phyllophora nervosa - 13,6 м2/кг. В то же время сезонные и однолетние водоросли, как правило, имеют большую удельную поверхность талломов: Acrochaetium thuretii - 440,0; Goniotrichum elegans - 295,4; Callithamnion corymbosum -181,5; Polysiphonia sanginea - 80,6; Corallina mediterranea - 66,7 м2/кг массы слоевища. Некоторые многолетние сцифальные красные водоросли, обитающие в сублиторали (Apoglossum ruscifolium, Gelidium crinale, Gracilaria verrucosa), также имеют большую удельную поверхность талломов (табл. 2).
Поскольку большинство видов водорослей с высокой удельной поверхностью слоевища относятся к сезонным формам, активная поверхность сообщества ИР претерпевает заметные изменения в разные периоды года. Максимальная величина этого параметра сообщества характерна для лета, когда сезонные водоросли достигают наибольшей плотности популяции. Увеличение активной поверхности биоценоза происходит и в результате заселения твердого субстрата и талломов водорослей микроэпифитами. Так, наиболее благоприятные условия для роста бентосных диатомей отмечаются для глубин 5-7 м, где волнение моря ослабевает, а условия освещенности вполне достаточны для их роста.
Среди бентосных диатомей, колонизирующих субстрат рифа и талломы, обнаружены сезонно-летние (Striatella unipunctata, S. interrupta), а также осеннее-зимние виды, которые встречаются на слоевищах цистозиры круглый год: одноклеточные (Cocconeis scutellum, Licmophora ehrenbergii, Navicula directa) и колониальные (Achnanthes brevipes, Synedra tabulata) формы. При этом видовой состав эпифитов на слоевищах оставался практически постоянным, поскольку численность массовых видов диатомовых водорослей существенно превышала таковую сезонных форм. Биомасса диатомовых обрастаний на талломах цистозиры и филлофоры на ИР на глубине 7 м составляла в среднем 37,5 ± 8,0 г/м2 и 45,9 ± 9,2 г/м2 соответственно.
Покрытый бактериями, диатомеями и простейшими субстрат постепенно заселяли корковые формы красных водорослей, среди которых наиболее многочисленными были L. lenormandi, P. polymorphum,
Rhodochorton penicilliforme, которые образовывали нижний ярус сообщества макроводорослей рифа. Формирование последующих ярусов биоценоза ИР происходило практически одновременно. При этом верхний ярус, создающий основной фон сообщества, образовывали цистозира или филлофора, под покровом которых получали развитие красные и бурые водоросли второго и третьего ярусов: Ceramium rubrum, Corallina mediterránea, Gelidium latifolium G. crínale, Laurencia obtusa, Cladostephus verticillatus. Слоевища последнего располагаются под пологом цистозиры или филлофоры. Под слоевищами кладостефуса, в свою очередь, поселяются С. medinerranea и другие низкорослые красные водоросли. Эпифитные синузии, как уже упоминалось, на талломах водорослей разных ярусов наиболее активно формировались весной, когда начинался бурный рост сезонных и однолетних водорослей.
Таблица 2
Биомасса (г/м2) и удельная поверхность массовых видов красных, бурых водорослей
в фитоценозе Cystoseira сгтНа

* Среди сопутствующих видов в фитоценозе на разных глубинах встречались также красная -Apoglossum ruscifolium, бурая - Cladostephus verticilatus, зеленые - Cladophora sericea, Enteromorpha intestinalis, Codium vermilare, но их биомасса была менее 1,0 г/м2.
Оказалось, что обрастанию эпифитами наиболее подвержены бурые и зеленые водоросли: цистозира, сфацилярия, кладостефус и кладофора. Многие красные водоросли обрастали диатомеями в меньшей степени из-за гладкой поверхности слоевища и, вероятно, в результате выделения метаболитов, препятствующих колонизации, поскольку отмершие слоевища обычно обрастали диатомовыми эпифитами.
Колонизация каменистого субстрата ИР личинками бентосных организмов начинается сразу же после постановки рифа, если время совпадало с периодом планктонной стадии развития эпибионта. Весной при температуре воды 15-16 °С на каменистый субстрат начинали оседать молодь митилид (Mytilus galloprovinciales) и через 3-4 месяца основная часть особей в популяции достигает размера 10,9 ± 5,8 мм и массой особи 350,5 ± 67,3 мг. В период оседания личинок митилид (M. galloprovinciales, Mytilaster lineatus) их плотность в околорифовом пространстве превышала 400 экз./м3. Летом створки мидий и ракушечник покрывались белыми известковыми сеточками мшанок Lepralia pallasiana. На небольшой глубине (до 3 м) вокруг балянусов, поселившихся на ракушечнике, обнаруживались многочисленные мелкие (до 1 мм) известковые раковины многощетинковых червей - спирорбисов (Spirorbis militaris). Эти эпибионты поселялись и на слоевищах водорослей: осенью и зимой в основном на филлофоре, а летом - и на цистозире. С ростом глубины до 7 м на створках митилид и талломах филлофоры поселялись малиновые с белыми звездочками колонии асцидии Botryllus schlosseri. На этой же глубине створки мидий часто покрывали яркие оранжевые, синие и сиреневые губки, на которых к осени поселялись многочисленные гидроиды (Aglaophenia pluma), образуя "заросли" в несколько сантиметров высотой.
Следует отметить, что колонизация слоевищ водорослей и заселение ракушечника на искусственном рифе идет сходным образом. В то же время наблюдаются определенные особенности. В табл. 3 приведены данные о биомассе массовых групп эпибионтов, обнаруживаемых на слоевищах видов-эдификаторов фитоценозов ИР. Относительно высокая биомасса моллюсков на цистозире по сравнению с филлофорой обусловлена наличием многочисленных гастропод Bittium reticulatum, Rissoa splendid, R. membranacea.

Моллюски: ЫуН!ш galloprovincialis, Mytilaster lineatus, ВШЫт Шки1аШт, Rissoa splendida. Ракообразные: Amphytoe уаШап^, Сирге11а acantifera, Hyppolyte longistris, Idotea ЬаШса, Naesa bidentata. Полихеты: Nereis zonata, Platynereis dumeriШ, Spirorbis militaris, S. ршШа. Анализ собственных данных и результатов многих исследователей по обрастанию ИР свидетельствуют о том, что среди беспозвоночных практически не встречаются виды, избирательно поселяющиеся на каменистых или растительных субстратах. Ранее отмечалось, однако, что в Черном море усоногие раки и полихеты преимущественно колонизируют слоевища цистозиры, а мидии и мшанки предпочитают селиться на более широких талломах филлофоры [17]. Причина такой избирательности в субстрате, возможно, связана с различной чувствительностью гидробионтов к действию выделяемых красными водорослями метаболитов, способных ингибировать их рост. Известно, например, что аллохимические вещества, выделяемые красными кораллиновыми водорослями, препятствуют развитию проростков ламинарии и росту других гидробионтов [18].
Способы прикрепления эпибионтов к субстрату ИР чрезвычайно разнообразны: створками раковины, известковыми домиками, конечностями, трубками и нитями слизи и т. д. Интенсивное обрастание ИР эпифауной весной начинается с прогревом воды выше +10 °С. В годы, когда температура воды в начале весны превышала +10 °С и нерест мидий происходил активно, они одними из первых колонизировали ИР, часто вытесняя усоногих раков, поселяясь после их отмирания на известковых домиках. Мшанки, которые часто заселяли отдельные участки рифа, также не являлись препятствием для обрастания субстрата моллюсками. К началу лета мидии достигали размера 4-5 мм и их биомасса составляла 70 % от биомассы всех эпибионтов, поселившихся на рифе. Биомасса макроэпифитов на цистозире в разные сезоны изменялась от десятков до сотен граммов на килограмм слоевища. Причем численность макрозооэпифитона на рифе по сравнению с окружающей средой возрастала в 6-7 раз, а биомасса увеличивалась лишь в 2 раза из-за высокой плотности, которая ограничивала рост отдельных особей в популяции. Хотя на ИР иногда обнаруживалось до 30 и более таксонов беспозвоночных число массовых видов обычно не превышало десятка видов. Причем размеры большинства животных были менее 10 мм.
Природная среда обладает поразительной способностью к самоочищению, если не нарушено динамическое равновесие обмена вещества и энергии в экосистеме, которые определяют интенсивность биологической очистки. Нарушения в прибрежных морских экосистемах могут иногда возникать в результате природных явлений, однако чаще они являются следствием антропогенного воздействия на самое слабое звено биотического сообщества. При этом антропогенные факторы, как правило, не вызывают новых эффектов, а лишь увеличивают частоту и масштаб нарушений структуры и функции биотической компоненты экосистемы, как и любые внешние для экосистемы факторы.
Среди трофических групп бентосных организмов на ИР были обнаружены как неподвижные, так и малоподвижные формы гидробионтов. Неподвижные организмы-фильтраторы были представлены в основном гидроидными полипами и губками. Малоподвижные организмы на ИР-моллюски, усоногие раки, мшанки и некоторые сидячие формы полихет являются пассивными фильтраторами, которые процеживают взвесь, используя естественный и/или создаваемый ими поток воды. Среди этой группы гидробионтов были обнаружены тонкие и грубые фильтраторы, занимающие биотоп от уреза воды до границы эвфотической зоны. Другая трофическая группировка бентосных организмов включает подвижных фильтраторов, которые способны мигрировать в слои, богатые взвешенным веществом: морских ежей, равноногих раков, моллюсков родов Са^ит, Мас^а, Serripes, которые нами на ИР не были обнаружены, но могут встречаться в околорифовом пространстве, особенно в эстуариях и на литорали.
Известно, что мелкие планктонные ракообразные и двустворчатые моллюски на каждый миллилитр потребляемого кислорода отфильтровывают от 4 до 40 л воды. Откуда следует, что при температуре воды 20 °С на 1 г сырой массы они потребляют 1 мл кислорода за 1 ч, фильтруя в сутки 360 л на 1 г массы тела [7]. Для мидий при биомассе 500 г/м2 массы сухого вещества скорость фильтрации составляет 21 г/ч, или 24 м3 на 1 м2 мидиевой щетки в сутки [19; 20]. На одном из исследованных нами рифов на глубине 7 м при биомассе МуШш galloprovinciales 100 г/м2, Ва^пш improvisus - 40 г/м2, Spirorbis sp. - 10 г/м2 фильтрация воды этими гидробионтами на каждом 1 м2 ИР составляла (без учета мшанок, полихет и асцидий) более 50 м3 воды в сутки. Скорость фильтрации воды! грубыми фильтраторами - веслоногими раками колеблется в интервале
50-100 мл на особь в сутки, а ветвистоусых раков, которые являются тонкими фильтраторами, всего 1-15. Практически с такой же скоростью фильтруют многие коловратки.
Размеры фильтруемых гидробионтами частиц зависит от устройства фильтрационного аппарата. Мидии, фильтрующие воду жабрами, способны улавливать частицы размером 4 мкм на 100 %, а более мелкие (до 2 мкм) - только на 80 %. Моллюски р. Cardium эффективно отфильтровывают частицы крупнее 6 мкм, р. Chlamis - 8 мкм, а р. Crassostera - крупнее 9 мкм. Указанные гидробионты способны фильтровать и более мелкие частицы взвеси, однако эффективность фильтрации падает до 25 %. Асцидии, фильтрующие жабрами, расположенными в глотке, которая многочисленными щелями открывается в клоакальный сифон, способны отфильтровывать частицы размером 1-2 мкм. У мшанок с ярко выраженным полиморфизмом особей в колонии фильтрующий аппарат представляют собой расположенные по кругу щупальца, с помощью которых они загоняют частицы детрита и планктон в ротовое отверстие. Губки с помощью жгутиков загоняют воду с взвесью в поры системы каналов жгутиковых камер и затем в парагастральную полость. Захват пищевых частиц осуществляют клетки стенок каналов и хоаноциты. Усоногие раки фильтруют частицы грудными ножками, высовывая их из известковых домиков [21; 22].
Заключение
Одним из подходов к решению проблемы "чистой воды" является сооружение искусственных рифов в прибрежной зоне моря с соблюдением фундаментальных экологических принципов, позволяющих найти оптимальный путь. Такое сооружение обеспечивает направленное формирование биотического сообщества с последующим управлением хода экологической сукцессии доминирующих и сопутствующих гидробионтов на ИР и околорифовом пространстве. Как показали наши исследования, разные сроки колонизации гидробионтами рифа и экологические сукцессии в биотическом сообществе позволяют осуществлять эффективную очистку морских вод в течение всего года, наиболее эффективно - во время вегетационного периода, когда антропогенная нагрузка на экосистему оказывается максимальной.
В. И. Капков, Е. В. Шошина, О. А. Беленикина
Комментариев нет:
Отправить комментарий